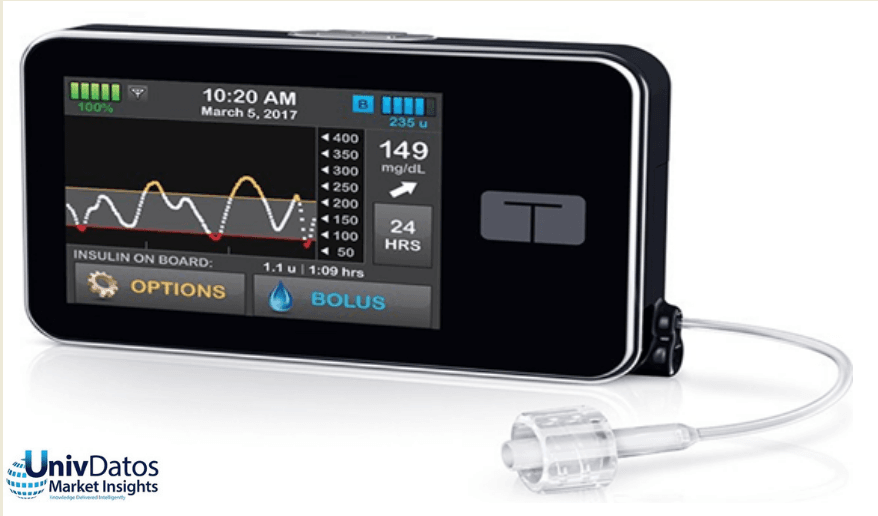
FDA、TandemのT:Slim X2を初の「相互運用可能」インスリンポンプとして承認
糖尿病は、体の血糖値を処理する能力を損なう疾患であり、最も一般的で費用のかかる慢性疾患の1つです。糖尿病患者のグルコース、血圧、脂質レベルを集中的に治療することで、糖尿病関連の合併症を発症するリスクが大幅に軽減されます。
最近では、2019年2月に、米国食品医薬品局(FDA)が、Tandem Diabetes Care Inc.に対し、相互運用可能な技術を搭載したt:Slim X2インスリンポンプの販売承認を与えました。これまで、インスリンポンプは、単一の定義済みの糖尿病管理システム(クラスIII、最高リスクのデバイス)の一部としてFDAによって承認されるか、スタンドアロンデバイス(クラスII、中程度のリスクのデバイス)としてFDAによって承認されてきました。t:Slim X2インスリンポンプは、他の糖尿病デバイスコンポーネントと相互運用可能であるため、デノボ市販前審査経路を通じて審査されています。
デジタルヘルスの進歩により、糖尿病ケアに対するより個別化されたアプローチが可能になりました。このt:Slim X2ポンプは、一定または可変の速度で皮膚の下にインスリンを送達することで機能します。デジタルで接続でき、他の糖尿病管理デバイスから薬剤投与コマンドを受信できます。これにより、Tandem Diabetes Careがインスリンポンプ業界の主要なイノベーターとしての役割をさらに確立しました。この目的のために、iCGM互換として承認された最初のタッチスクリーンポンプを発売しました。このポンプは、パーソナルコンピューターを利用してリモートソフトウェアアップデートが可能であり、ユーザーは必要な規制要件を満たすと新しい機能にアクセスできる可能性があります。
t:slim X2は、米国で入手可能な他のすべての耐久性のあるインスリンポンプよりも少なくとも25%小型であり、主要な競合他社の1社が提供する最新のインスリンポンプフォームファクターよりも38%小型です。t:flexは同様の洗練されたポンプフォームファクターを提供し、480ユニットのインスリンを含むカートリッジを利用して、より多くのインスリンを必要とする人々に強化された柔軟性を提供します。
米国成人の3分の1以上が前糖尿病であり、人口の大部分は診断されていません。およそ、成人の4人に1人が糖尿病を患っており、人口は約720万人です。
American Diabetes Associationによると、世界中で75万人から100万人がインスリンポンプを使用していると推定されています。国内では、米国の約55万人がインスリンポンプを使用しており、そのうち約80%が1型糖尿病であると推定されています。これは、糖尿病市場におけるt:Slim X2ポンプの大きな機会を示しています。
この分野の主要なプレーヤーには、Roche (Accu-Chek Combo)、Insulet Corporation (Omnipod)、Medtronic (Minimed 530G System; 630G System)、および Animas (Vibe)が含まれます。
